一次性使用配藥用注射器的技術審查要點

二、技術審查要點
(一)產品名稱要求
產品名稱應符合《醫療器械通用名稱命名規則》(國家食品藥品監督管理總局令第19號)等相關法規、規范性文件的要求。產品名稱應以體現產品的工作原理、技術結構特征、功能屬性為基本準則,如 “一次性使用配藥用注射器”。
(二)產品的結構和組成
一次性使用配藥用注射器由配藥器配藥針組成。
典型的配藥器結構為二件、三件;型式為中頭式、偏頭式;容量有10 mL、20 mL、30 mL、50 mL、100 mL等。一般由標尺、零刻度線、分度容量線、公稱容量刻度線、外套卷邊、錐頭、外套、活塞、芯桿、按手組成。
典型的配藥針型式為側孔針、斜面針;規格有0.9mm、1.2 mm、1.4 mm、1.6 mm、1.8 mm、2.1 mm、2.4 mm等;一般由針座、針管、護套組成。
一次性使用配藥用注射器結構如如圖1所示。
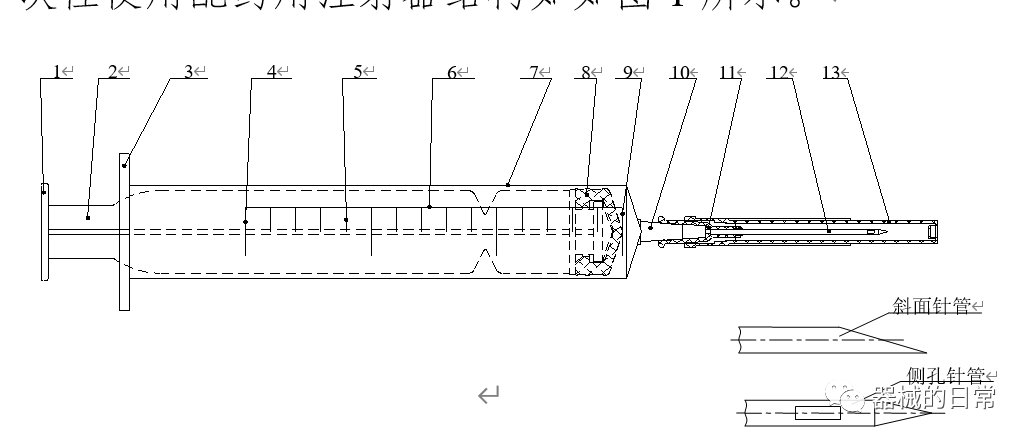
圖1
1.按手;2.芯桿;3.外套卷邊;4.公稱容量刻度線;5.分度容量線;
6.標尺;7.外套; 8.活塞;9.零刻度線;10.錐頭;11.針座;
12.針管;13.護套
注:本示意圖僅說明配藥器的結構,并非為標準規定的唯一型式。
產品圖示舉例如圖2

圖2
(三)產品工作原理/作用機理
一次性使用配藥用注射器臨床使用時是借助外力推(拉)配藥器芯桿帶動活塞抽吸藥液注入輸液容器內;或先吸取稀釋劑,將稀釋劑注射進入粉針瓶中使粉針劑溶解,再將稀釋好的藥液注入輸液容器內,供患者輸液用。
因該產品為非直接治療類醫療器械,故本指導原則不包含產品作用機理的內容。
(四)注冊單元劃分的原則和實例
一次性使用配藥用注射器注冊單元原則上以產品的技術原理、結構組成、性能指標和適用范圍為劃分依據。
如產品結構、功能特殊應另行劃分注冊單元。
(五)產品適用的相關標準
表1 相關產品標準
標準編號 | 標準名稱 |
GB 15810—2001 | 《一次性使用無菌注射器》 |
GB 15811—2016 | 《一次性使用無菌注射針》 |
GB 18279.1—2015 | 《醫療保健產品滅菌環氧乙烷第1部分:醫療器械滅菌過程的開發、確認和常規控制的要求》 |
GB/T 18279.2—2015 | 《醫療保健產品的滅菌環氧乙烷第2部分:GB 18279.1應用指南》 |
GB/T 191—2008 | 《包裝儲運圖示標志》 |
GB/T 1962.1—2015 | 《注射器、注射針及其他醫療器械用6%(魯爾)圓錐接頭第1部分:通用要求》 |
GB/T 2828.1—2012 | 《計數抽樣檢驗程序第1部分:按接收質量限(AQL)檢索的逐批檢驗抽樣計劃》 |
GB/T 2829—2002 | 《周期檢驗計數抽樣程序及表(適用于對過程穩定性的檢驗)》 |
GB/T 14233.1—2008 | 《醫用輸液、輸血、注射器具檢驗方法第1部分:化學分析方法》 |
GB/T 14233.2—2005 | 《醫用輸液、輸血、注射器具檢驗方法 第2部分:生物學試驗方法》 |
GB/T 16886.1—2011 | 《醫療器械生物學評價第1部分:風險管理過程中的評價與試驗》 |
GB/T 16886.5—2017 | 《醫療器械生物學評價第5部分:體外細胞毒性試驗》 |
GB/T 16886.10—2017 | 《醫療器械生物學評價第10部分:刺激與皮膚致敏試驗》 |
GB/T 16886.11—2011 | 《醫療器械生物學評價第11部分:全身毒性試驗》 |
GB/T 18457—2015 | 《制造醫療器械用不銹鋼針管》 |
GB/T 19633.1—2015 | 《最終滅菌醫療器械包裝第1部分:材料、無菌屏障系統和包裝系統的要求》 |
GB/T 19633.2—2015 | 《最終滅菌醫療器械包裝第2部分:成形、密封和裝配過程確認的要求》 |
YY/T 0114—2008 | 《醫用輸液、輸血、注射器具用聚乙烯專用料》 |
YY/T 0242—2007 | 《醫用輸液、輸血、注射器具用聚丙烯專用料》 |
YY/T 0243—2016 | 《一次性使用注射器用活塞》 |
YY/T 0296—2013 | 《一次性使用注射針識別色標》 |
YY/T 0313—2014 | 《醫用高分子產品包裝和制造商提供信息的要求》 |
YY/T 0316—2016 | 《醫療器械風險管理對醫療器械的應用》 |
YY/T 0466.1—2016 | 《醫療器械用于醫療器械標簽、標記和提供信息的符號第1部分:通用要求》 |
YY/T 0821—2010 | 《一次性使用配藥用注射器》 |
(注:本指導原則中標準適用最新版本,下同)
上述標準包括了注冊申報資料中涉及到的標準。有的注冊申請人還會根據產品的特點引用一些行業外的標準和一些較為特殊的標準。
產品適用及引用標準的審查可以分兩步來進行。首先對引用標準的齊全性和適宜性進行審查,也就是在編寫注冊申報資料時是否引用與產品相關的國家標準、行業標準,以及引用是否準確。可以通過對注冊申報資料中引用文件是否引用了相關標準,以及所引用的標準是否適宜來進行審查。此時,應注意標準編號、標準名稱是否完整規范,年代號是否有效。
其次對引用標準的采納情況進行審查。即所引用的標準中的條款要求,是否在產品技術要求中進行了實質性的條款引用。這種引用通常采用兩種方式,文字表述繁多內容復雜的可以直接引用標準及條文號,比較簡單的也可以直接引述具體要求。
如有新版強制性國家標準、行業標準發布實施,產品性能指標等要求應執行最新版本的國家標準、行業標準。
(六)產品的適用范圍/預期用途/禁忌癥
產品供臨床抽取、溶解、配制藥液使用。應該當明確說明該器械不適宜運用的某些疾病、情況或特定人群(如兒童、老年人、孕婦及哺乳器婦女、肝腎功能不全者)。

